নাইট্রেট এবং নাইট্রাইটের মধ্যে মূল পার্থক্য হল যে নাইট্রেটে নাইট্রোজেন পরমাণুর সাথে বন্ধনযুক্ত তিনটি অক্সিজেন পরমাণু থাকে যেখানে নাইট্রাইটটিতে দুটি অক্সিজেন পরমাণু থাকে যা একটি নাইট্রোজেন পরমাণুর সাথে বন্ধন থাকে।
নাইট্রেট এবং নাইট্রাইট উভয়ই নাইট্রোজেন এবং অক্সিজেন পরমাণু সমন্বিত অজৈব আয়ন।এই উভয় anion একটি -1 বৈদ্যুতিক চার্জ আছে.এগুলি প্রধানত লবণ যৌগের আয়ন হিসাবে ঘটে।নাইট্রেট এবং নাইট্রাইটের মধ্যে কিছু পার্থক্য আছে;আমরা এই নিবন্ধে যারা পার্থক্য আলোচনা করা হবে.
নাইট্রেট কি?
নাইট্রেট হল একটি অজৈব আয়ন যার রাসায়নিক সূত্র NO3–।এটি একটি পলিয়েটমিক অ্যানিয়ন যার 4টি পরমাণু রয়েছে;একটি নাইট্রোজেন পরমাণু এবং তিনটি অক্সিজেন পরমাণু।অ্যানিয়নের সামগ্রিক চার্জ রয়েছে -1।এই অ্যানিয়নের মোলার ভর হল 62 গ্রাম/মোল।এছাড়াও, এই অ্যানিয়নটি এর কনজুগেট অ্যাসিড থেকে প্রাপ্ত;নাইট্রিক অ্যাসিড বা HNO3।অন্য কথায়, নাইট্রেট হল নাইট্রিক অ্যাসিডের সংযোজিত ভিত্তি।
সংক্ষেপে, নাইট্রেট আয়নের কেন্দ্রে একটি নাইট্রোজেন পরমাণু থাকে যা সমযোজী রাসায়নিক বন্ধনের মাধ্যমে তিনটি অক্সিজেন পরমাণুর সাথে আবদ্ধ হয়।এই অ্যানিয়নের রাসায়নিক গঠন বিবেচনা করার সময়, এটিতে তিনটি অভিন্ন NO বন্ধন রয়েছে (আয়নের অনুরণন কাঠামো অনুসারে)।তাই, অণুর জ্যামিতি হল ত্রিকোণীয় প্ল্যানার।প্রতিটি অক্সিজেন পরমাণু একটি −2⁄3 চার্জ বহন করে, যা অ্যানিয়নের সামগ্রিক চার্জকে -1 হিসাবে দেয়।
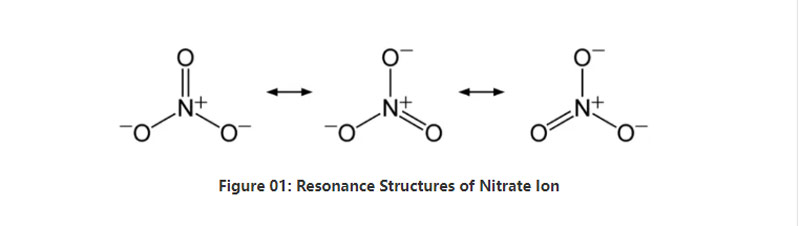
স্ট্যান্ডার্ড চাপ এবং তাপমাত্রায়, এই আয়ন ধারণকারী প্রায় সমস্ত লবণ যৌগ জলে দ্রবীভূত হয়।আমরা আমানত হিসাবে পৃথিবীতে নাইট্রেট লবণ প্রাকৃতিকভাবে ঘটতে পারে;নাইট্রেটিন জমা।এতে প্রধানত সোডিয়াম নাইট্রেট থাকে।অধিকন্তু, নাইট্রিফাইং ব্যাকটেরিয়া নাইট্রেট আয়ন তৈরি করতে পারে।নাইট্রেট লবণের একটি প্রধান ব্যবহার হল সার উৎপাদনে।তদ্ব্যতীত, এটি বিস্ফোরকগুলিতে অক্সিডাইজিং এজেন্ট হিসাবে কার্যকর।
নাইট্রাইট কি?
নাইট্রাইট হল একটি অজৈব লবণ যার রাসায়নিক সূত্র NO2–।এই অ্যানিয়নটি একটি প্রতিসম অ্যানিয়ন, এবং এটির একটি নাইট্রোজেন পরমাণু দুটি অক্সিজেন পরমাণুর সাথে দুটি অভিন্ন NO সমযোজী রাসায়নিক বন্ধনের সাথে সংযুক্ত রয়েছে।তাই, নাইট্রোজেন পরমাণু অণুর কেন্দ্রে থাকে।অ্যানিয়নের সামগ্রিক চার্জ রয়েছে -1।
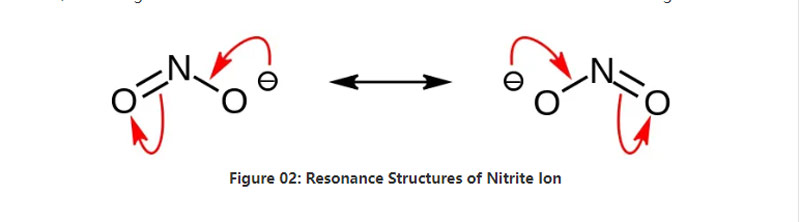
অ্যানিয়নের মোলার ভর হল 46.01 গ্রাম/মোল।এছাড়াও, এই অ্যানিয়নটি নাইট্রাস অ্যাসিড বা HNO2 থেকে প্রাপ্ত।সুতরাং, এটি নাইট্রাস অ্যাসিডের সংযোজিত ভিত্তি।অতএব, আমরা নাইট্রাস ধোঁয়াকে জলীয় সোডিয়াম হাইড্রোক্সাইড দ্রবণে প্রেরণের মাধ্যমে শিল্পগতভাবে নাইট্রাইট লবণ উত্পাদন করতে পারি।অধিকন্তু, এটি সোডিয়াম নাইট্রাইট উৎপন্ন করে যা আমরা পুনরায় ক্রিস্টালাইজেশনের মাধ্যমে বিশুদ্ধ করতে পারি।অধিকন্তু, সোডিয়াম নাইট্রাইটের মতো নাইট্রাইট লবণ খাদ্য সংরক্ষণে কার্যকর কারণ এটি খাদ্যকে জীবাণুর বৃদ্ধি থেকে রোধ করতে পারে।
নাইট্রেট এবং নাইট্রাইটের মধ্যে পার্থক্য কী?
নাইট্রেট হল একটি অজৈব আয়ন যার রাসায়নিক সূত্র NO3– যেখানে নাইট্রাইট হল একটি অজৈব লবণ যার রাসায়নিক সূত্র NO2– রয়েছে।অতএব, নাইট্রেট এবং নাইট্রাইটের মধ্যে প্রাথমিক পার্থক্য দুটি অ্যানিয়নের রাসায়নিক গঠনের উপর নির্ভর করে।এটাই;নাইট্রেট এবং নাইট্রাইটের মধ্যে মূল পার্থক্য হল যে নাইট্রেটে নাইট্রোজেন পরমাণুর সাথে বন্ধনযুক্ত তিনটি অক্সিজেন পরমাণু থাকে যেখানে নাইট্রাইটটিতে দুটি অক্সিজেন পরমাণু থাকে যা নাইট্রোজেন পরমাণুর সাথে বন্ধন থাকে।অধিকন্তু, নাইট্রেট আয়ন এর কনজুগেট অ্যাসিড থেকে উদ্ভূত হয়;নাইট্রিক অ্যাসিড, যখন নাইট্রাইট আয়ন নাইট্রাস অ্যাসিড থেকে উদ্ভূত হয়।নাইট্রেট এবং নাইট্রাইট আয়নগুলির মধ্যে আরেকটি গুরুত্বপূর্ণ পার্থক্য হিসাবে, আমরা বলতে পারি যে নাইট্রেট একটি অক্সিডাইজিং এজেন্ট কারণ এটি একমাত্র হ্রাস করতে পারে যেখানে নাইট্রাইট অক্সিডাইজিং এবং হ্রাসকারী উভয় এজেন্ট হিসাবে কাজ করতে পারে।
পোস্টের সময়: মে-16-2022





